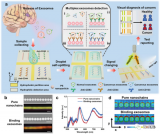
外泌体和其他小细胞外囊泡 (sEV) 是细胞间通讯和代谢调节的重要介质,包含蛋白质、编码和非编码 RNA、DNA和代谢物,存在于生物体的体液中,包括血浆/血清、尿液和脑脊液。sEV内容物受生理和病理状态影响,因此它们可用作诊断和预测多种疾病预后的标志物。过去的研究主要针对sEV中miRNA,而对蛋白质组的研究较少。本文作者利用质谱技术研究不同细胞系分泌sEV中的蛋白质组特征,发现不同细胞类型的sEV中蛋白质的独特性质,以及这些蛋白质的表达水平如何用作识别组织来源的生物标志物。
02图解摘要
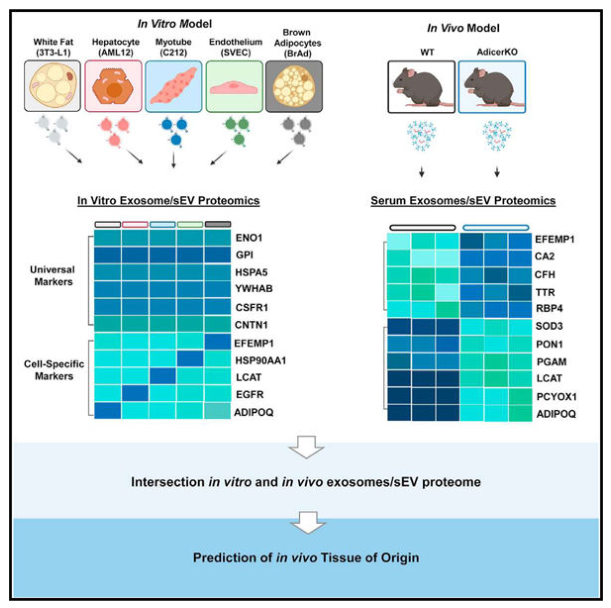
通过比较蛋白质组学,作者确定了来自多种细胞类型的外泌体/sEV共有的标志物,以及每种细胞类型独有的标志物。使用脂肪营养不良小鼠模型,揭示了sEV蛋白质组数据集来预测体内循环外泌体/sEVs的起源组织的用途。
03研究内容
1、细胞产生的sEVs具有不同的蛋白质组特征
研究者从5个代谢调节小鼠模型细胞系提取外泌体和sEVs,大小在50到200纳米之间,并通过NTA分析确定大小分布在5个细胞系中没有区别,但各细胞系释放颗粒的速度有很大区别,分化的3T3-L1释放sEVs最快,而分化的C2C12释放的最慢。为了探究这些不同细胞释放的sEVs中蛋白质组的差异,研究者利用LC-MS/MS质谱技术分析蛋白质组成,共鉴定到431种蛋白质。GO富集分析结果表明这些蛋白质多为胞外蛋白(细胞表面或分泌蛋白),或位于细胞质和质膜上,功能上主要参与蛋白质代谢、大分子处理、信号转导和应激反应。利用PCA分析将5个细胞系分为2个clusters,一个包含C2C12(肌管)和AML12(肝细胞),一个包含3T3-L1(脂肪细胞)、BrAd和SVEC(内皮细胞)。通路富集分析表明,内皮细胞与白色和棕色脂肪细胞释放的sEV富集了参与分解代谢过程和有机酸、羧酸、氮化合物代谢的蛋白质,且差速离心法分离出的sEVs中检测到了10种糖酵解途径中的酶。内皮细胞与棕色和白色脂肪细胞的sEVs富集了脂肪酸合成和脂蛋白代谢的重要酶蛋白。肝细胞和肌管释放的sEVs参与细胞迁移/黏附、免疫反应、细胞结构调节和脂质与甘油磷脂代谢。这些结果表明,尽管这些细胞系存在显著的代谢差异,但它们的sEVs中蛋白质组存在意想不到的相似性,将这些细胞系分成2种模式。
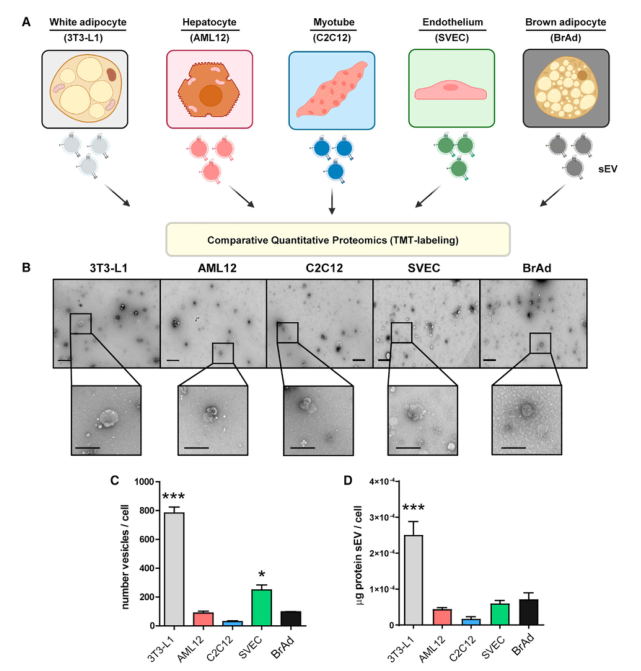
Fig.1 实验设计和各细胞类型释放的sEV的表征
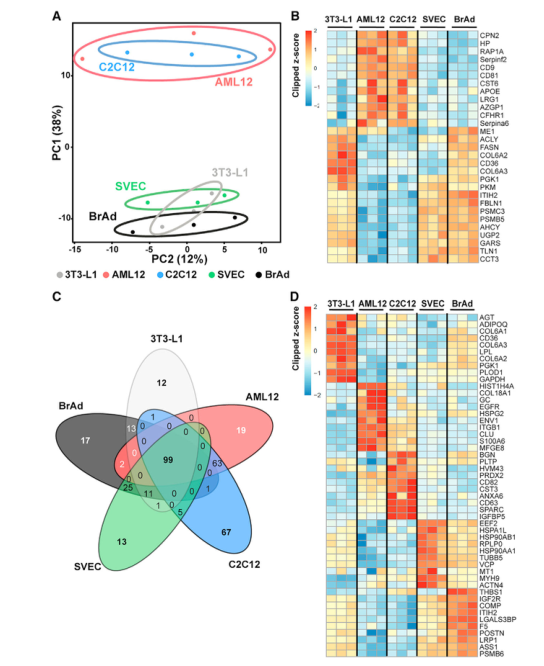
Fig.2 在分离的sEV中观察到的蛋白质组表达模式
2、不同细胞系sEV蛋白marker鉴定
Tetraspanins家族蛋白CD63、CD9和CD81,在过去研究表明,在sEV中表达丰富,因此常常被用作sEV鉴定、定量或纯化的marker。然而,在研究者的结果中,这三个蛋白质在不同细胞系中的表达水平有很大差异。脂肪和肌管细胞系中的sEVs表达水平高,但在内皮细胞和白色与灰色脂肪细胞中表达水平低。相反,研究者从自己的质谱结果中鉴定到6个在sEV中表达水平相似的蛋白质,可能是更好的sEV蛋白marker,分别是ENO1、GPI、HSPA5、YWHAB、CNTN1和CSF1R。前四个蛋白质被预测定位于sEV管腔,后两个被归为膜蛋白,因此也可以作为表面marker。
用WB对5种细胞系特异性表达的蛋白质进行分析,鉴定了每个细胞类型的特异性marker,即3T3L1:ADIPOQ、CD36;AML12:EGFR、ITGB1;C2C12:SPARC、IGFBP5;SVEC:HSP90;BrAd:POSTN、THBS1。此外,进入sEVs的蛋白质可能与这些蛋白质在细胞类型的丰度和外泌体分泌通路有关。WB结果表明,一些蛋白质在sEV和细胞的表达水平成比例,如ADIPOQ、SPARC、FASN、IGFBP5。而其他一些蛋白在某些细胞类型的sEVs中与其他细胞类型相比显著上调,而在细胞表达水平相似,表明存在细胞类型特异性机制使得这种蛋白被分选进入sEV中。从培养细胞和原代细胞提取sEV并用质谱分析蛋白质组,发现培养细胞(3T3-L1)sEV特异表达的蛋白也富集在原代细胞sEV中,表明两种来源的sEV蛋白质组非常相似。
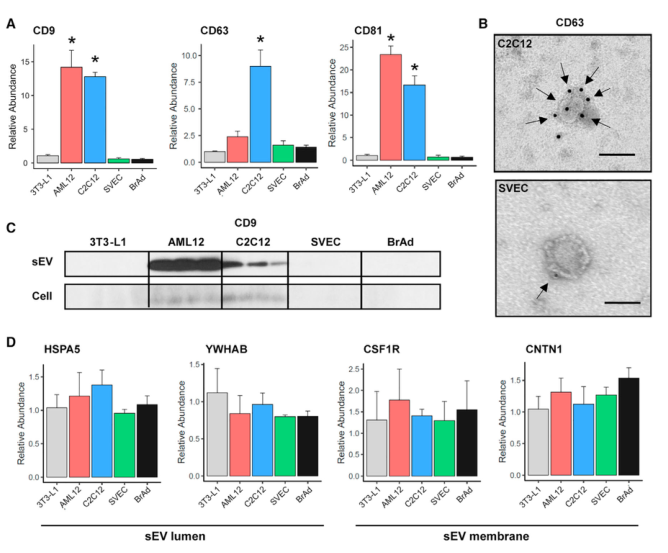
Fig.3 Tetraspanins在不同细胞类型的sEV中表达并不相同
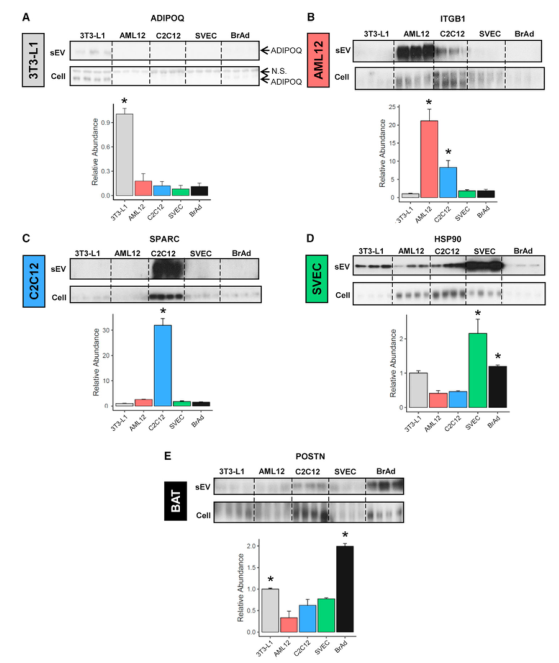
Fig.4每种细胞类型SEV标志物的免疫印迹
3、血清sEV蛋白作为代谢性疾病组织变化的指标
为了确定sEV蛋白质组是否发生改变并可能有助于代谢表型,研究者从12周大的对照和 AdicerKO小鼠中分离出血清sEV,并对它们进行比较蛋白质组学分析。其中86个蛋白质在对照和KO小鼠之间表达不同,AdcerKO的sEV中40个上调和46个下调。富集分析表明上调通路top10中包含视黄醇代谢和补体激活途径,下调通路top10中包含炎症反应和铁代谢。有趣的是,表达水平高度变化的蛋白质包括通常由肝脏、脂肪和其他组织分泌的蛋白质。为了追踪AdicerKO sEV中显著改变的蛋白质的来源,研究者将这些蛋白质中的每一种与前文确定的细胞类型特异sEV蛋白质的体外数据交互分析,发现其中三种在KO模型中上调的蛋白来自肝细胞,只有一种蛋白质来自SVEC且在KO模型中上调表达,25种蛋白质来自肌肉细胞,其中12种上调,13种下调。重要的是,有5种蛋白可能是脂肪细胞特异的,且这些蛋白在sEV的表达变化与对应组织中该蛋白的表达水平变化一致。这些数据表明,血清sEV中蛋白质丰度的变化可以反映组织质量和组织中蛋白质表达的变化,这些组织选择性地将这些蛋白质输出到它们的sEV中。
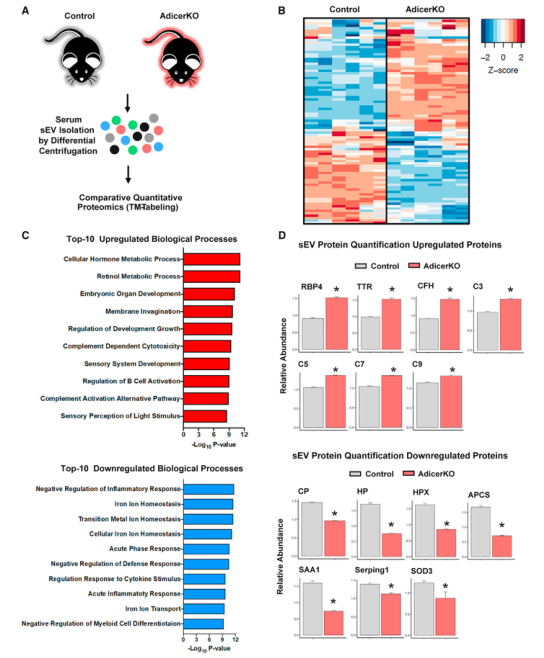
Fig.5 AdicerKO小鼠血清sEV蛋白质组的变化
4、脂联素作为白色脂肪细胞sEV的标志物
脂肪因子ADIPOQ是一种重要的胰岛素增敏剂,由脂肪细胞独特分泌,是白色脂肪sEV独特的标志物。HMW脂联素是其主要的生物活性形式,在与其受体AdipoR1/2结合时,以组织依赖性方式激活AMPK或PPARγ通路。此外,HMW脂联素与内皮细胞中的 T-钙粘蛋白结合,调节血管形成,并已被证明可刺激sEV释放。免疫金标法证实sEV中存在ADIPOQ,sEV分离前后血清进行WB和ELISA分析发现血清中的大部分ADIPOQ是游离的,sEV组分中仅存在一小部分,其主要存在形式为MMW和HMW。在AdcerKO小鼠中,血清和sEV中两种形式的丰度均有所下降。考虑到对照和AdicerKO小鼠的sWAT中的ADIPOQ蛋白表达相似,这可能是由于在KO组中观察到的脂肪营养不良而发生的。为了确定sEV中的ADIPOQ是在囊泡表面还是在囊泡内腔中,研究者在用Triton X-100破坏囊泡膜之前和之后都用蛋白酶K处理了sEVs,发现蛋白酶K能够在添加去污剂前后消化与sEV相关的ADIPOQ。因此,ADIPOQ是位于这些sEV外膜上的白色脂肪细胞sEV的独特标志物,有可能与 ADIPOQ受体结合并影响这些外泌体/sEVs的靶向性。
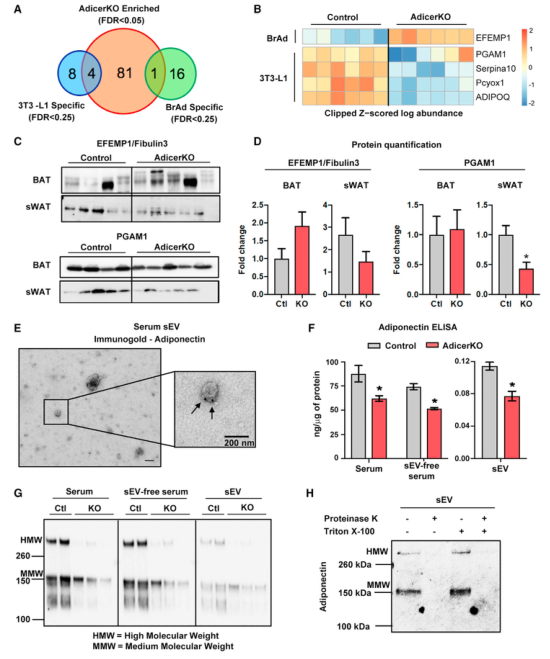
Fig.6 高分子量ADIPOQ在AdicerKO小鼠sEV中表达下调
04结果总结
本研究对可代表重要代谢组织的五种细胞系进行定量蛋白质组分析,发现每一种细胞类型都有独特的sEV蛋白质组表达模式。虽然 CD9/CD63/CD81等经典sEV标志物的丰度差异很大,但研究者还确定了六种sEV标志物(ENO1、GPI、HSPA5、YWHAB、CSF1R 和CNTN1)。它们在所有细胞类型的sEV中丰度相似。此外,每种细胞类型都有特定的sEV标志物。使用白色脂肪组织减少和棕色脂肪组织增加的脂肪特异性Dicer敲除小鼠,研究者证实这些细胞类型特异性标志物可以预测血清sEV的变化起源。这些结果为了解在代谢稳态中重要的细胞和组织的sEV蛋白质组、识别独特的sEV标志物以及证明这些标志物如何帮助预测血清sEV的组织来源提供了宝贵的资源。
审核编辑:郭婷
-
编码
+关注
关注
6文章
940浏览量
54811 -
DNA
+关注
关注
0文章
243浏览量
31026
原文标题:学术动态 | NTA +LC-MS/MS组合在外泌体蛋白质组研究的应用
文章出处:【微信号:SBCNECB,微信公众号:上海生物芯片】欢迎添加关注!文章转载请注明出处。
发布评论请先 登录
相关推荐
浅谈瑞盟科技·MS2581/MS2581M——低功耗 RS-422 接口电路

MS8241/MS8242——高速、高输出电流、电压反馈放大器

MS5182N/MS5189N——16bit、4/8 通道、250kSPS、 SAR 型 ADC

MS5198T/MS5199T——低噪声、低功耗、16/24 位 ∑-Δ ADC

MS5196T/MS5197T——低噪声、低功耗、16/24 位∑-ΔADC

差示扫描量热仪测试蛋白质的应用案例

创客中国AIGC专题赛冠军天鹜科技:AI蛋白质设计引领者

EvolutionaryScale推出基于NVIDIA GPU模型的新型蛋白质研究方案
洪亮团队在生信期刊JCIM发布最新成果,蛋白质工程迈入通用人工智能时代
天府锦城实验室在生物传感与蛋白质测序领域取得重要进展

ms2130和ms2131有什么区别
对新辅助TCHP治疗响应的HER2+乳腺癌空间蛋白质组特征

基于印刷工艺的分区光学生物芯片用于外泌体可视化检测




 NTA +LC-MS/MS组合在外泌体蛋白质组研究的应用
NTA +LC-MS/MS组合在外泌体蛋白质组研究的应用










评论