药物筛选是药物发现的关键步骤,当前的药物筛选大多数是基于单一作用靶标的单药物筛选,靶细胞(肿瘤细胞)一旦产生耐药性,针对单一作用靶标的单一药物对肿瘤细胞的杀伤性就会大大削弱。
而人体疾病的产生和发展往往伴随着复杂的基因通路的改变,相比于单药物,多重药物可以通过作用于多个通路的多个靶标从而发挥更好的治疗效果,有着可降低耐药性和疾病复发可能性的优势。
然而,由于待检测药物组合数量巨大,并且现有的基于细胞形态或细胞增殖率的表型分析策略相对简单,导致目前已知的有效的药物组合较少。
近期,深圳大学李自达助理教授与深圳市华大生命科学研究院刘亚副研究员合作,完成了利用单细胞测序和微液滴操控、实现高通量多重药物筛选的工作。相关研究成果于近日以“Combinatorial perturbation sequencing on single cells usingmicrowell-based droplet random pairing”为题发表在Biosensors& Bioelectronics上。
该项工作得到国家重点研发计划、广东省自然科学基金、深圳市海外高层次人才科研启动经费和深圳大学青年教师科研启动经费的资助。
在该研究中,研究团队使用基于微孔的液滴随机配对实现对单个细胞的组合扰动并测序(CP-seq),通过在组合药物处理下的单细胞转录组的变化来表征组合药物对单细胞的基因扰动情况。
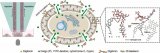
CP-seq利用连接了刀豆蛋白的寡核苷酸对药物进行编码(图1a),将药物和细胞分别封装在不同的液滴中(图1b),在微孔阵列芯片上将细胞液滴与两个药物液滴随机配对,从而完成对细胞的组合药物处理和编码标记(图1c)。
在随后的单细胞转录组测序中可以同时检测单细胞的转录组信息和药物编码,用于解码相应的药物处理条件(图1d)。
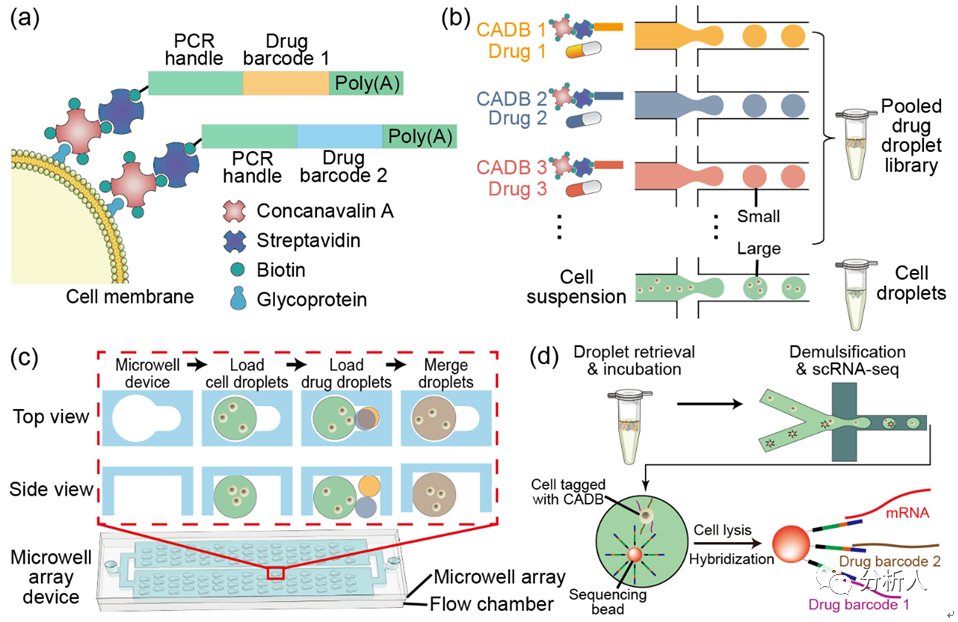
图1 CP-seq流程示意图。(a)连接有寡核苷酸序列(药物编码)的刀豆蛋白对细胞进行标记;(b)细胞液滴的生成和药物液滴池的生成与集合;(c)在微孔阵列上实现细胞液滴和随机的组合药物液滴的捕获、配对及融合;(d)融合后的液滴进行回收孵育后,液滴破乳回收经过组合药物处理后的被标记的细胞来进行单细胞测序,测序磁珠通过poly(T)尾巴同时捕获mRNA和药物编码。
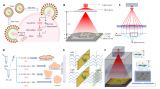
对液滴的稳定***是CP-seq技术的基础。因此,研究团队首先通过系列实验优化和表征了高度稳定的液滴微流控***性能。研究团队利用注射器施加负压的方式可稳定生成尺寸可控的包裹不同内容物的液滴(变异系数小于5%),并且在使用8000/μL的细胞密度下有着超高的细胞液滴利用率(97.9%的细胞液滴包裹至少一个细胞)。在液滴配对过程中,药物液滴的尺寸是一个重要的参数。例如,当药物液滴的直径为50μm而不是43μm时,只有20.4%的微孔捕获了两个药物液滴,77.7%的微孔捕获了一个药物液滴。
在液滴捕获、配对和融合过程中,高达83%的微孔利用率表现出CP-seq平台良好的微流控液滴***性能。最后,研究团队进行了电晕处理实现液滴融合的方式对细胞基因表达影响的探究,通过与对照组的UMAP聚类图比较,发现电晕处理对细胞基因表达的影响可忽略不计。
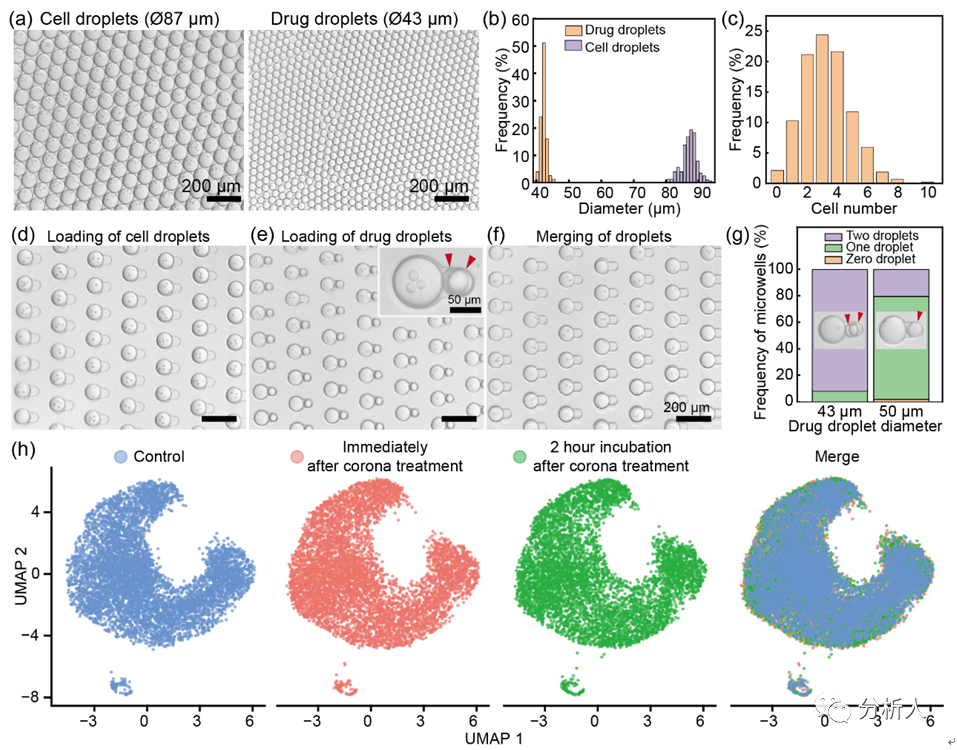
图2 液滴微流控的平台性能表征。(a-b)细胞液滴和药物液滴的显微图片和直径分布直方图;(c)每个细胞液滴内细胞个数的分布;(d-f)细胞液滴的捕获、药物液滴的捕获和液滴融合的显微图片,每个过程中的微孔利用率分别为99%、92%和90%;(g)不同尺寸的药物液滴在药物液滴捕获过程中的差异;(h)单细胞测序数据的UMAP聚类图展示电晕处理对细胞基因表达的影响。
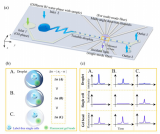
在验证CP-seq具有良好的液滴***性能后,鉴于经过选定的药物单独处理后的细胞的基因表达已经有广泛的研究,可以作为参考的标准,因此研究团队通过进行单药物处理来验证CP-seq的可靠性。通过对细胞进行不同孵育时间(4、8、12小时)的单药物处理(3种不同浓度的4种药物以及1组空白对照),研究团队发现不同孵育时间下的细胞的基因表达具有显著差异。
并且,随孵育时间的提高,选定的抗癌药物的目标基因的表达量的变化趋势和过往文献中报导的一致,充分证明了CP-seq平台在单药物处理中的良好的可靠性。
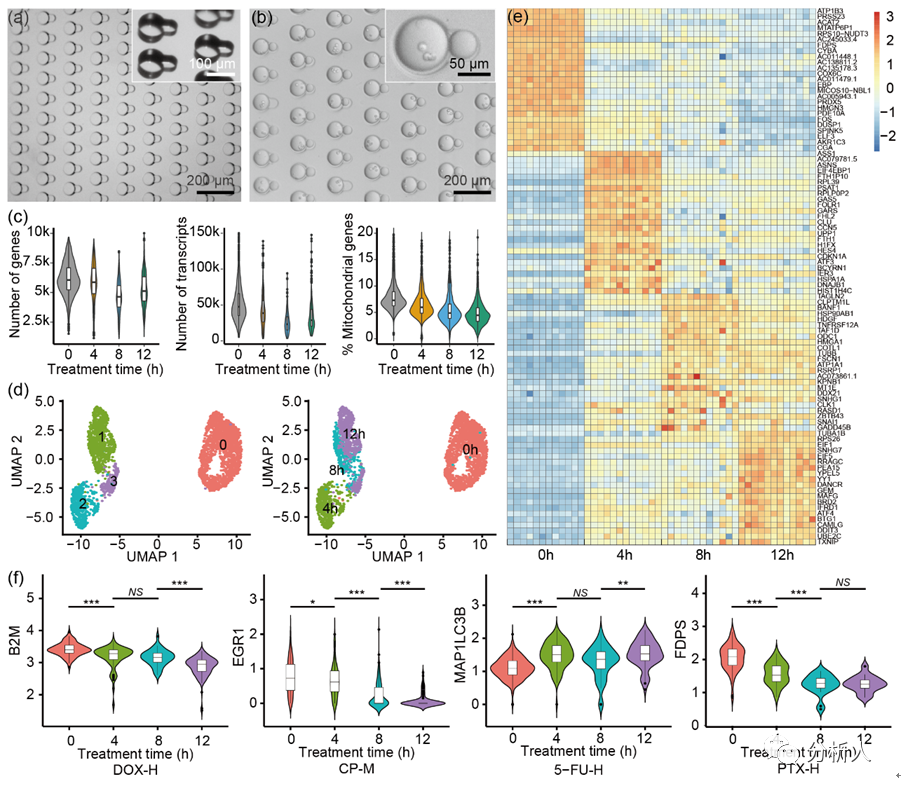
图3 通过单药物处理验证CP-seq的可靠性。(a)用于捕获单一药物液滴的微孔阵列芯片,大小孔具有不同的深度;(b)捕获了细胞液滴和单一药物液滴的显微图片;(c)在0、4、8和12小时的药物处理条件下,对单细胞测序结果进行质量控制;(d)UMAP聚类散点图;(e)不同孵育时间下基因表达的热图,每列代表相应孵育时间下的药物处理条件;(f)代表性基因在不同药物孵育时间下的基因表达变化。
最后,研究团队实施CP-seq的完整流程以进行进一步的验证。13种药物条件中的两种可能的组合数量为78种。在非孵育组,共回收出71种药物组合(图4a),缺少的七种组合可能是在数据过滤中由于质控不合格而被剔除。在孵育组***回收了47种药物组合,这些组合的数量比非孵育组少,可能是由于组合药物处理诱导细胞死亡。
研究团队接着通过对细胞组分的基因富集分析来得到这两个实验组之间细胞组分的差异。结果表明,未进行孵育组中富集到的基因类别主要与细胞核中的染色体有关,其基因具有有丝分裂等功能(图4b)。相比之下,组合药物孵育1小时组富集的基因类别主要是核糖体和线粒体成分,可能表明高细胞正处于高度应激状态。
然后,研究团队将组合药物处理1小时与单一药物处理4、8、12小时的转录组信息做比较,并通过火山图展示(图4c),其中,MALAT1、NEAT1和B2M等基因的差异表达充分证明CP-seq在组合药物处理下分析细胞的转录组信息的能力。
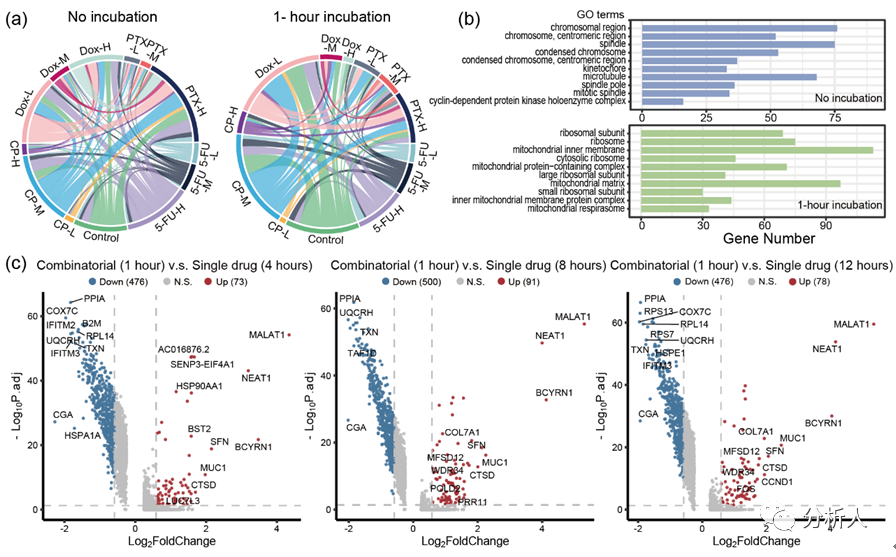
图4 通过组合药物处理验证CP-seq的可靠性。(a)和弦图展示单细胞测序数据中回溯出的药物组合情况,分为未孵育组和组合药物孵育1小时组;(b)未孵育组和组合药物孵育1小时组的细胞组分的基因富集分析;(c)火山图表示组合药物孵育一小时的细胞与单药物孵育 4 小时、8 小时和 12 小时的差异基因表达的比较。
综上所述,实验中使用的载玻片大小的微孔阵列芯片大约有26800个微孔单元,每个微孔平均可容纳3个细胞,在20个微孔的样本大小(~60个细胞)情况下,一张芯片原则上可以同时进行1300种药物组合的处理。除了两种药物的组合外,在每个微孔单元中加入额外的小微孔,CP-seq就具有适用于测试多种药物组合的潜力。因此,利用液滴微流控在高通量筛选中的优势,CP-seq可以在一次实验中测试数千种药物组合,有望成为一种用于高通量和深入分析的组合药物筛选新技术,极大地促进新药物组合的发现。
论文链接: https://doi.org/10.1016/j.bios.2022.114913
审核编辑:刘清
-
微流控芯片
+关注
关注
13文章
270浏览量
18829
原文标题:基于液滴微流控的单细胞测序技术,实现高通量多重药物筛选
文章出处:【微信号:Micro-Fluidics,微信公众号:微流控】欢迎添加关注!文章转载请注明出处。
发布评论请先 登录
相关推荐
使用原代肿瘤细胞进行药物筛选的数字微流控系统
高通量生物分析技术之微流控芯片
华大发布两款纳米孔测序仪
中国移动浙江公司携手华为完成5G-A高通量UPF全球现网首呼
采用集成光子技术的片上流式细胞仪,瞄准高通量细胞分析

赋能产业互联网,高通量计算让世界更高效!

基于双极性电极阵列的微流控芯片,可实现细胞可控、非接触三维旋转

浅析推动生命科学发展的光泵半导体激光(OPSL)技术(一)
荧光显微镜细胞图像检测实战




 单细胞测序技术实现高通量多重药物筛选
单细胞测序技术实现高通量多重药物筛选










评论