微流控芯片(microfluidic chip),又称微全分析系统(micro total analysis system,ì-TAS)或者芯片实验室(lab-on-a-chip),是指把化学和生物等领域中所涉及的样品制备、反应、分离、检测及细胞培养、分选、裂解等基本操作单元集成或基本集成到一块几平方厘米(甚至更小)的芯片上,由微通道形成网络,以可控流体贯穿整个系统,用以取代常规化学或生物实验室的各种功能的一种技术平台。
细胞是生物体和生命活动的基本单位,细胞分析对于细胞结构和功能的研究、生命活动规律和本质的探索、疾病的诊断与治疗、药物的筛选与设计等都具有十分重要的意义。自微流控芯片面世以来,以其微型化、集成化、自动化和便携化等优势越来越多地应用在细胞分析领域。
微流控芯片
微流控芯片具有分离效率高、分析速度快、分离模式多、所需样品少、应用范围广、自动化程度高等优点,充分体现了当今分析设备微型化、集成化、自动化和便携化的发展趋势,被广泛应用在生命科学、疾病诊断与治疗、药物合成与筛选、农作物育种与改良、环境监测与控制和战时对病原体检测等领域。
芯片细胞分析技术的优点
微流控芯片用于细胞分析,有如下的优点:
(1)微通道的尺寸与细胞尺寸相当,在微流控芯片上对细胞的研究可深入到单细胞甚至亚细胞器水平。
(2)微尺寸通道、多维网络结构和相对封闭的环境,接近体内的生理状态,可实现无损或者微损检测。
(3)平板式几何构型,更容易进行观察、检测;而且传热、传质迅速,提高分析的精确度和灵敏度。
(4)可以将诸多细胞研究操作步骤集成在同一块芯片上,有利于平行操作和连续分析。
(5)可以满足高通量细胞分析的需要,同时获取大量的生物学信息。
(6)芯片设计灵活多样,可与相关分析仪器集成或联用。
(7)节省时间、样品和试剂,有利于降低研究成本。
芯片细胞分析技术的分类
细胞操纵
微流控芯片细胞操纵是将细胞运送到预定的位点,将其固定后,进行细胞成分、结构和功能等分析。通常地,这还包括了对目标细胞的分离和筛选。在微流控芯片上运送和固定生物细胞,要求操作简便、高效,同时能保持细胞活性。目前在微流控芯片上进行细胞操纵的方法主要有:机械操纵法、光学操纵法、电场操纵法和磁力操纵法等。Chen等对各种细胞操纵分选技术进行了详细的报道。
(1)机械操纵法
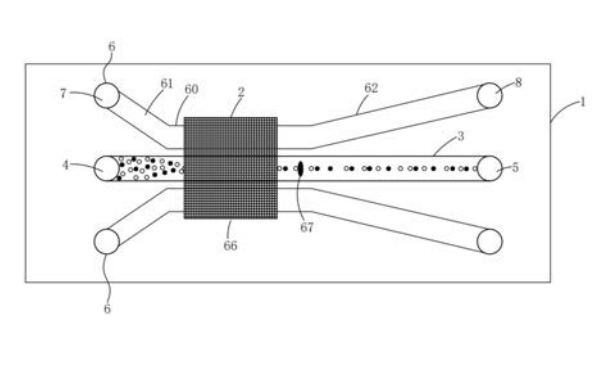
机械操纵法主要是指利用微机械加工技术,在芯片上刻蚀出各种结构,如微筛、微阱、微沟、梳状、堰状、沙袋等,根据细胞尺寸的差异进行物理分离的一种方法。它具有工作原理简单,不需要特殊的缓冲液等优点。缺点是制作微结构较复杂,而且要求目标细胞和杂质细胞必须有明显的尺寸差异。Lee研究小组在微流控芯片细胞机械操纵方面做了大量的研究工作。如他们设计了一种含有U型截留结构阵列的微流控装置,每个U型截留单元无需表面修饰,可在30s内截留并固定单细胞,进而可进行细胞培养和细胞分析。陈兴等制备了一种错流过滤式细胞分离微流控芯片,有效地避免了芯片堵塞问题;且采用坝式分离结构,提高了血细胞中白细胞和红细胞的分离效率。孙悦等采用传统光刻技术和三步刻蚀法制作了一多深度通道的微流控芯片,在分离通道中设置了围堰,保证了单细胞在分离通道中的准确定位和静态溶膜,电泳分离后进行激光诱导荧光检测(LIF),分析了人类单个肿瘤细胞中的谷胱苷肽和活性氧。
(2)光学操纵法
光学操纵的基本原理是:当光束照射到细胞时,对细胞产生作用力,细胞被捕获在光束的焦点附近;或者在这个力的作用下,细胞被运送到目标检测分析位置。光学操纵法的优点是不接触、不损伤细胞,污染少,便于微尺寸范围的精细操作,可达微米级的精确定位;缺点是设备昂贵,仅适于细胞短距离操纵。光学操纵常用的是光镊技术(optical tweezers or optical traps),其可对细胞进行精确的定位。Ramser等用一集成了拉曼光谱、激光光镊的微流控芯片的装置,对单个红细胞进行操控和光谱收集,从拉曼光谱特征峰位置、强度和线宽可实时监测细胞中的氧循环和光诱导作用对细胞内物质相互作用的影响,也可以进行细胞内药物效应的实时检测。光镊技术可用于荧光激发细胞分选(fluorescence activated cell sorter,FACS)。FACS是指对细胞进行荧光标记,以激光激发出的荧光信号的有无或强弱控制细胞的流向。Wang等设计的一种微流控装置,可精确控制细胞位移而达到细胞分选的目的。细胞在激光束的照射下,通过绿色荧光蛋白表达发出荧光的细胞在光镊作用下流向收集池,而非绿色荧光蛋白表达的细胞因未受光镊作用而流向废液池。为满足微流控芯片体积小、高通量和低成本的需要,在光学操纵中还使用了垂直腔面发射激光器(vertical cavity surface emitting lasers)及其阵列。Shao等研制了一显微集成的VCSELs阵列截留系统装置,能够独立控制和批量处理生物细胞,便于进行平行操作。
细胞培养
细胞培养是指从体内组织取出细胞,vwin 体内生存环境,在无菌、适当温度及酸碱度和一定营养条件下,使其生长繁殖并维持结构和功能的一种培养技术。细胞培养常采用瓶皿或微孔板。但是,细胞的体积微小,这些传统的皿板提供的培养环境明显与体内环境相差甚远,难以真实反应生理状态下细胞的生物学特征性。微流控芯片具有相对封闭的多维网络结构,通道尺寸与细胞尺寸相当,而且芯片制作材料众多、结构设计灵活多样,因而越来越多地应用于细胞培养。在微流控芯片上进行细胞培养的常用方法是灌流式培养(microfluidic perfusion culture),是指将细胞悬液注入微通道或者微培养室,待细胞贴壁后,将培养液连续灌入培养区域,实现营养物质的连续更新。以下是一些应用微流控芯片进行细胞培养的研究报道。
单细胞内组分分析
细胞内组分复杂,对细胞内成分的分析和测定、细胞成分间的相互作用的研究,有助于研究者了解体内细胞的代谢过程、细胞内信号转导和细胞的功能,对疾病的治疗和药物筛选等具有重大的意义。微流控芯片技术的出现为细胞内组分分析提供了一个很好的技术平台。
(1)荧光检测
Zare研究组设计了一种具有多层聚二甲基硅氧烷(PDMS)结构的微流控芯片,该芯片集成了细胞操纵、试剂引入及运输、细胞裂解、胞内氨基酸荧光标记、电泳分离及LIF检测等多种功能,实现了对单个T淋巴瘤细胞内6种氨基酸的检测。最近,他们又在微流控芯片上操纵、溶胞、标记、电泳分离和测定了单个昆虫细胞(SF9)中的低含量蛋白质。Culbertson等报道在微流控芯片上高通量操纵单细胞进样、快速电溶胞、电泳分离和荧光检测,并将其应用于分子细胞学的研究。
(2)电化学检测
程介克研究组研制了一种安培检测微流控芯片系统,采用碳纤维纳米电极。他们用该装置系统成功地测定了小鼠PC12细胞中的多巴胺。与传统的微电极相比,其灵敏度和分辨率都大大提高了。Wang等采用微流控装置结合电化学检测研究了测定人单个血红细胞中谷胱甘肽(GSH)的方法,细胞的进样、定位、溶膜以及细胞中谷胱甘肽的转移和检测都在配有通道端安培检测器的双T形芯片中完成。
-
芯片
+关注
关注
455文章
50714浏览量
423113 -
微流控
+关注
关注
16文章
525浏览量
18885
原文标题:微流控芯片细胞分析技术简介
文章出处:【微信号:Microfluidics-Tech,微信公众号:微流控科技】欢迎添加关注!文章转载请注明出处。
发布评论请先 登录
相关推荐




 微流控芯片细胞分析技术的分类及优点
微流控芯片细胞分析技术的分类及优点












评论