近日,中国科学院国家纳米科学中心李乐乐课题组在DNA纳米生物技术用于核酸递送的研究中取得新进展。相关研究成果“Engineering Multifunctional DNA Hybrid Nanospheres through Coordination-Driven Self-Assembly”于12月20日以Hot Paper发表在《德国应用化学》杂志上(Angew. Chem., Int. Ed. 2018, DOI: 10.1002/anie.201810735)。
作为一种功能性生物大分子,DNA已被广泛用于分析化学、医学诊断和疾病治疗。由于DNA难以穿过细胞膜且易被降解,如何实现DNA有效递送成为该领域发展的关键。目前,研究人员开发了各种类型的纳米载体(例如:高分子胶束、脂质体、无机纳米粒子),以实现体外和体内核酸递送,但面临着制备困难、效率低和安全性差的问题。近年来,DNA纳米技术得到了迅猛发展,并在核酸及小分子药物递送方面展现出巨大的潜力。DNA自组装纳米结构主要包括:Ned Seeman团队发展的瓦块 (tile) 自组装,Paul Rothemund博士发明的DNA折纸术(DNA origami),以及Chad Mirkin课题组发展的球形核酸(spherical nucleic acids)。然而,这些方法往往需要使用大量预先设计的不同序列的核酸链进行组装或者对核酸特定位点进行修饰及表面功能化,如此复杂的合成方法阻碍了其在生物医学领域的广泛应用。因此,发展简单、高效的组装方法以构建多功能DNA纳米结构仍然是DNA纳米技术领域的一大难题。
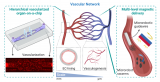
李乐乐课题组受传统金属-有机配位化学的启发,首次提出利用金属配位驱动自组装构建DNA纳米结构的新概念,发明了一种自组装合成DNA纳米结构的新方法学,构建了一类新型DNA纳米材料——金属-DNA纳米结构,并表明该体系可用于细胞及活体水平高效核酸递送。重要的是,该方法非常简单,只需要将DNA分子和金属离子(亚铁离子)在一定的温度下于水中混合,即可快速、高产率地获得具有球形形貌的金属-DNA纳米结构。而且,通过调节DNA分子和金属离子的比例及浓度,可以精准调控金属-DNA纳米结构的尺寸和组分。研究人员已将该金属-DNA纳米结构成功应用于核酸药物递送。研究表明,作为新颖的、无载体的核酸递送系统,金属-DNA纳米结构可将核酸药物有效地递送到不同的细胞中,并且在体外和体内均发挥高效的生物识别和药效作用。该工作展示了金属配位驱动的自组装在合成DNA纳米材料方面的潜力,为DNA纳米结构的构建开辟了新的方法学。相比于快速兴起和发展的金属-有机框架材料(MOFs),研究人员相信该类金属-DNA纳米材料将会极大地推进DNA纳米生物技术和金属配位化学领域的发展。此外,该方法将有助于设计多功能生物材料,应用于生物传感、生物成像和药物/基因递送。
该工作是李乐乐课题组在前期研究(J. Am. Chem. Soc. 2018. 140, 578-581;J. Am. Chem. Soc. 2017, 139, 13804-13810;Adv. Mater. 2018, 1804745)的基础上实现的。该研究得到国家人才计划和国家自然科学基金的支持。
-
纳米
+关注
关注
2文章
696浏览量
36976 -
DNA
+关注
关注
0文章
243浏览量
31026
原文标题:国家纳米中心DNA纳米生物技术研究取得进展
文章出处:【微信号:Micro-Fluidics,微信公众号:微流控】欢迎添加关注!文章转载请注明出处。
发布评论请先 登录
相关推荐
Qorvo在射频和电源管理领域的最新进展
中国科大在纳米级空间分辨红外成像研究中取得新进展
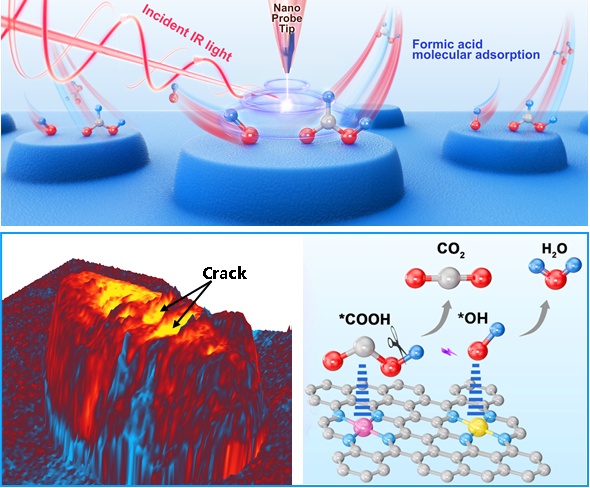
中国科大在纳米级空间分辨红外成像及催化研究中取得新进展
芯片和封装级互连技术的最新进展
5G新通话技术取得新进展
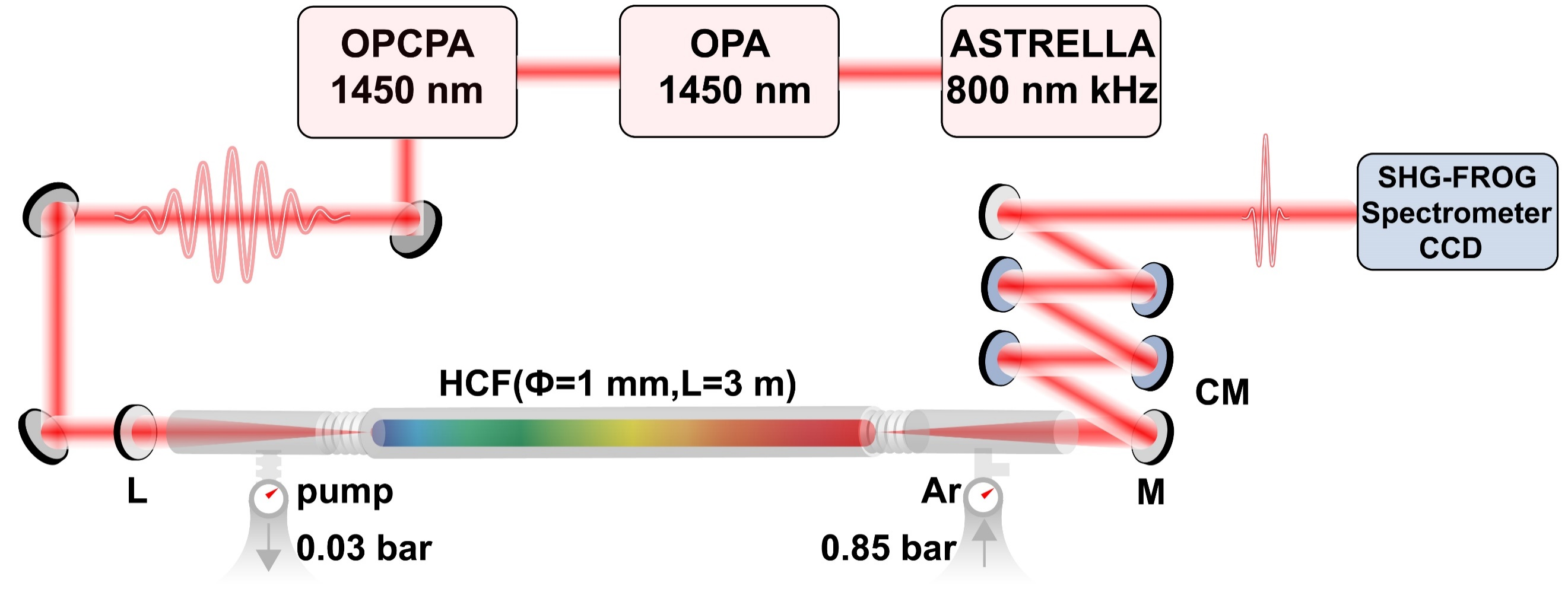
上海光机所在基于非线性压缩的太瓦级周期量级光源产生方面取得新进展
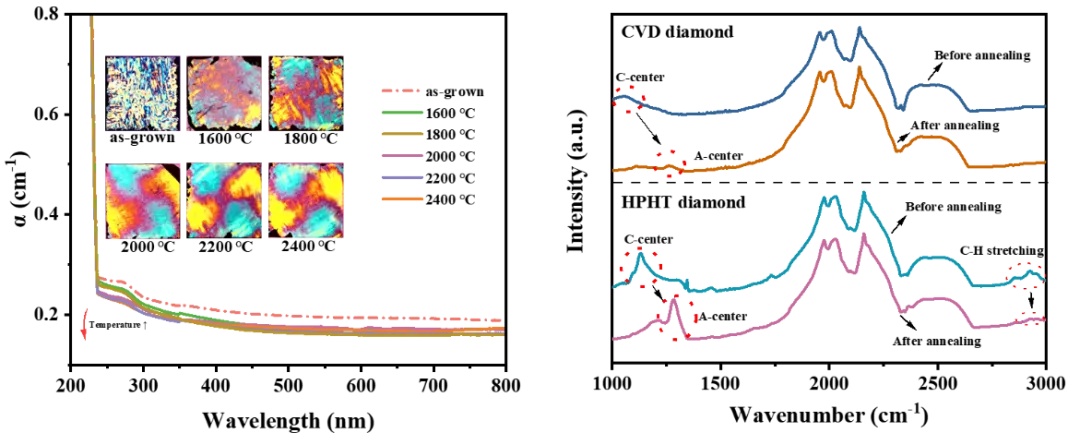
上海光机所在提升金刚石晶体的光学性能研究方面获新进展




 DNA纳米生物技术用于核酸递送的研究中取得新进展
DNA纳米生物技术用于核酸递送的研究中取得新进展












评论